上海交通大学附属中学 2018-2019 学年度第二学期高中一年级化学摸底测试
相对原子水平:H-1 C-12 N-14 O-16 Na-23 S-32 Cl-35.5 K-39 Br-80
1、选择题(每小题只有 1 个正确答案)(2*20 分)
1. 下列物质可以推行人工降雨的是( )
A. AgF B. AgCl C. AgBr D. AgI
2. 下列各组中两种微粒所含电子数不相等的是( )
A. ![]() H3O+和 OH- B. CO 和 N2 C. HNO2 和 NO2 D. CH3 和 NH4
H3O+和 OH- B. CO 和 N2 C. HNO2 和 NO2 D. CH3 和 NH4
3. 分类是化学研究的要紧办法,下列物质分类错误的是( )
A. 化合物:干冰、明矾、石碱 B. 同素异形体:石墨、C60、金刚石
C. 非电解质:乙醇、四氯化碳、氯气 D. 混合物:漂白粉、纯净矿泉水、碱石灰
4. 氢元素与其他元素形成二元化合物称为氢化物,有关氢化物的叙述正确的是( )
A. HF 的电子式![]() B. H2S 的空间构型为直线型
B. H2S 的空间构型为直线型
C. NH3 的结构式![]() D. CH4 是含非极性键的非极性分子
D. CH4 是含非极性键的非极性分子
5. 在“HI→HI→H2 和 I2”的变化过程中,被破坏有哪些用途力依次是( )
A. 范德华力、范德华力 B. 范德华力、共价键
 C. 共价键、离子键 D. 共价键、共价键
C. 共价键、离子键 D. 共价键、共价键
6. 可以产生如右图实验现象的液体是( )
A. CS2 B. CCl4 C. H2O D. 苯
7. 用漂粉精漂白时,对提升漂粉精漂白用途没有明显成效的是( )
A. 食盐 B. CO2 和水蒸气 C. NaHSO4 固体 D. 食醋
8. 将氯气持续通入紫色石蕊试液中,溶液颜色呈现如下变化:
关于溶液中致使变色的微粒Ⅰ、Ⅱ、Ⅲ的判断正确的是( )
A. H+、ClO-、Cl2 B. H+、ClO-、Cl- C. HCl、ClO-、Cl- D. H+、HClO、Cl2
9. 海带中含有碘元素,有人设计如下步骤来提取碘:①通适当氯气;②将海带烧成灰,向灰中加水搅拌;
③加 CCl4 振荡;④过滤;⑤用分液漏斗分液。适当的操作顺序是( )
A. ②④①③⑤ B. ②④③①⑤ C. ①③⑤②④ D. ③①②⑤④
10. 下列有关 HCl 和 HBr 的叙述错误的是( )
A. 键能:HCl>HBr B. 热稳定性:HBr>HCl
C. 沸点:HBr>HCl D. 共用电子对偏移程度:HCl>HBr
11. 将盛有 NH4HCO3 粉末的小烧杯放入盛有少量醋酸的大烧杯中,然后向小烧杯中加入盐酸,反应剧烈, 醋酸渐渐凝固(醋酸熔点约为 15℃)。这样来看( )
A. NH4HCO3 和盐酸的反应是放热反应
B. 该反应中,热能转化为产物内部的能量
C. 反应物的总能量高于生成物的总能量
D. 反应的热化学方程式为:NH4HCO3+HCl→NH4Cl+CO2 +H2O-Q
12. LED即发光二极管,是一种可以电能转化为光能的固态半导体器件。如图是某课外活动小组设计的用化学电源使 LED 灯发光的装置。下列说法不正确的是( )
A. 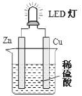 装置中存在“化学能→电能→光能”的转化
装置中存在“化学能→电能→光能”的转化
B. 溶液中 SO42-向负极移动
C. 铜为阳极,锌为阴极
D. 假如将锌片换成铁片,则电路中的电流方向不变
13. 铋(Bi)元素价态为+3 时较稳定,铋酸钠(NaBiO3)溶液呈无色。现取适量的硫酸锰(MnSO4)溶液,向其中依次滴加下列溶液,对应现象如表所示:
加入溶液 | ①适当铋酸钠溶液 | ②过量的双氧水 | ③适当 KI-淀粉溶液 |
实验现象 | 溶液呈紫红色 | 紫红色消失,产生气泡 | 溶液变为蓝色 |
关于 BaBiO3、KMnO4、I2、H2O2 的氧化性由强到弱的顺序为( )
A. I2、H2O2、KMnO4、NaBiO3 B. H2O2、I2、NaBiO3、KMnO4
C. NaBiO3、KMnO4、H2O2、I2 D. KMnO4、NaBiO3、I2、H2O2
14.
化学家觉得氢气与氮气在固体催化剂表面合成氨的反应过程可用如下示意图表示,其中过程⑤表示生成的 NH3 离开催化剂表面。下列剖析正确的是( )
① ② ③ ④ ⑤
A. 催化剂改变了该反应的反应热 B. 过程③为放热过程
C. 过程②是氢气与氮气分子被催化剂吸附 D. 过程④为吸热反应
15. 羰基硫(OCS)是一种有臭鸡蛋气味的无色气体,分子结构与 CO2 相似,高温下分解为 CO 和 S。下列有关说法正确的是( )
A. OCS、CO、CO2、S 四种物质的晶体种类相同
B. OCS 高温分解时,碳元素化合价升高
C. OCS 分子是非极性分子
D. 22.4L OCS 中约含有 3 ´6.02 ´ 1023 个原子
16. 右图分别表示红磷、白磷燃烧时的能量变化,有关说法正确的是( )
A. 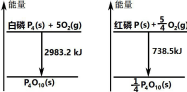 白磷比红磷稳定
白磷比红磷稳定
B. 白磷燃烧产物比红磷燃烧产物稳定
C. 1mol 白磷转变为红磷放出 2244.7KJ 的热量
D. 红磷燃烧的热化学方程式:4P+5O2→P4O10+2954KJ
17. 在反应 5NH4NO3 ¾D¾® 2HNO3+4N2 +9H2O 中发生氧化反应的氮原子和发生还原反应的氮原子的水平比是( )
A. 1:1 B. 3:5 C. 5:3 D. 1:4
18. 配制肯定物质的量浓度的 NaOH 溶液时,导致实验结果偏高的是( )
A. 转移溶液时有溶液洒落在外 B. 定容时察看液面俯瞰
C. 转移溶液后烧杯未洗涤 D. 容量瓶中原来有少量蒸馏水
19. 3.6g 碳在适量的氧气中燃烧,反应后生成的气体水平为 9.2g,则在标准情况下,生成物 CO 和 CO2
的体积比为( )
A. 3:2 B. 4:1 C. 5:1 D. 7:4
20. 现有 KCl、KBr 的混合物 3.87g,将混合物全部溶解于水,并加入过量的 AgNO3 溶液,充分反应后产生 6.63g 沉淀物,则原混合物中钾元素的水平分数为( )
A. 0.241 B. 0.259 C. 0.403 D. 0.487
2、综合剖析题
(一)
X、Y、Z、W、R 均是 1-18 号元素,原子序数依次增大。X 是所有元素中原子半径最小的元素,Y 原子最外层电子数是次外层电子数的 3 倍,Z、W、R 电子层数相同,R 与 Y 最外层电子数相同,Z、W 原子的核外电子数之和与 Y、R 原子的核外电子数之和相同。请回答下列问题:
21. 写出:W 的原子结构示意图____________________,R 离子的电子式____________________。
22. X、Y、Z 三种元素形成的化合物是____________________化合物(填“离子”或“共价”),其电子式为____________________。
23. X 与 Y 元素可形成一种常见的消毒剂,其结构式为____________________。
24. Y、Z、W、R 形成的简单离子半径由大到小顺序为____________________。
25. 写出由 X、Y、Z、R 四种元素形成的化合物的电离方程式____________________。
(二)
26. 碳元素能形成多种单质如金刚石、石墨等,24g 金刚石中含有____________________个碳碳单键。碳元素也能形成多 种化合物,在形成化合物时,其所成化学键以共价键为主,缘由是______________________________。
27. 工业制镁时,电解 MgCl2 而不电解 MgO 是什么原因____________________。
28. BeCl2 熔点较低,易升华,能溶于有机溶剂。由此可推断 BeCl2 晶体为______________________________晶体(填晶体种类),其分子为____________________分子(填“极性”或“非极性”),分子构型为____________________,BeCl2 熔点____________________(选填“低于”或“高于”)BeBr2。
(三)
世界上绝大多数卤素都存在于海洋。海水晒盐可以得到粗盐和卤水,对粗盐和卤水进一步加工可以得 到氯气、溴与其他一些要紧的化工商品。完成下列填空:
29. 工业上用电解饱和食盐水的办法获得氯气。写出电解饱和食盐水的离子方程式____________________。若转移 5mol 电子,生成氯气____________________L(标准情况下)。
溴主要以 Br-形式存在于海水中,海水呈弱碱性。工业上制备的 Br2 的操作步骤为:
①肯定条件下,将 Cl2 通入浓缩的海水中,生成 Br2
②借助热空气将 Br2 吹出,并用浓 Na2CO3 溶液吸收,生成 NaBr、NaBrO3、CO2
③用硫酸酸化步骤②得到的混合物
30. 先在卤水中加入硫酸酸化,然后再通入氯气,硫酸酸化可以提升氯气的借助率,缘由是____________________。
31. 写出步骤②化学方程式____________________。
32. 写出步骤③所发生的化学反应方程式并标出电子转移的方向和数目____________________。
33. 用上述办法制得的液溴常溶有少量氯气,除去氯气的办法是____________________。
 (四)
(四)
某化学兴趣小组欲用下列装置制备氯水并探究其性质。完成下列填空:
34. C 装置有哪些用途是____________________。
35. 氯水制备完成后,甲同学从 B 中取出适量的样品置于日光下照射一段时间,发现样品某些性质发生了明显的变化,请各列举一项: 物理性质变化:____________________;
化学性质变化:____________________。
36. 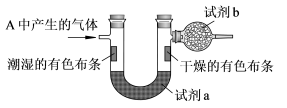 为证明氯气与水反应产物具备漂白性,丁同学将 A 中产生的气体缓缓通过下列装置:
为证明氯气与水反应产物具备漂白性,丁同学将 A 中产生的气体缓缓通过下列装置:
试剂 a 应选择____________________; 试剂 b 应选择____________________。
37. 戊同学从 B 中取出少量样品,滴到 NaHCO3 粉末上,有无色气泡产生,由此他觉得氯气与水反应至少产生一种酸性强于碳酸的物质。请评价他的看法是不是正确并说明理由____________________。
参考答案
1、选择题
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
D | D | C | C | B | C | A | D | A | B |
11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
B | C | C | C | A | D | C | B | C | C |
2、综合剖析题
![]() (一)21.
(一)21. ![]() ;
;
离子 ![]()
H-O-O-H
24. S2->O2->Na+>Al3+
25. NaHSO4→Na++H++SO42-
(二)26. 4NA;C 有 4 个价电子且半径较小,很难通过得或失电子达到稳定结构
MgCl2 和 MgO 均为离子晶体,Cl-半径大于 O2-半径,因此 MgO 晶体中离子键键能大于 MgCl2,熔点较高,熔融时消耗更多能量,增加生产本钱
分子;非极性;直线型;低于
(三)29. 2Cl-+2H2O ¾通¾电¾® Cl2↑+H2↑+2OH-;56
海水呈弱碱性,氯气在海水中发生副反应 Cl2+OH-→ClO-+Cl-+H2O,导致损耗,加入硫酸可中和海水的弱碱性防止副反应发生
3Br2+3Na2CO3→NaBrO3+5NaBr+3CO2↑
NaBrO3+5NaBr+3H2SO4→3Na2SO4+3Br2+3H2O
加入溴化钠溶液,搅拌,静置,分液
(四)34. 吸收多余氯气
物理变化:溶液颜色变浅;化学变化:溶液酸性增强(或漂白性减弱等)
CaCl2;碱石灰
不正确,由于 A 中会挥发出 HCl 进入 B 中,使溶液中存在盐酸。







